México sufre los efectos de una pandemia debida al virus SARS-CoV-2, causante de la enfermedad COVID-19. Sólo basta con salir a la calle, sin olvidar la Sana Distancia, para observar los efectos que este microorganismo ha dejado en la sociedad.
En respuesta a esta amenaza, las instituciones de salud y los laboratorios clínicos han dedicado gran parte de sus esfuerzos a detectar y tratar esta nueva enfermedad. Lamentablemente, pese a la infraestructura e inversión, las instituciones se han visto rebasadas al no poder dar abasto a la creciente demanda de usuarios que buscan un diagnóstico debido a la rapidez con que se disemina el virus.
Al identificar esta problemática, múltiples grupos de investigación y empresas privadas han desarrollado los denominados “kits de detección rápida". Aunque en algunas ocasiones resultan útiles para realizar pruebas de detección del virus en un paciente, estos desarrollos han mostrado ser inadecuados al usualmente ser poco sensibles, poco específicos, no conclusivos en la detección del virus y suelen requerir infraestructura y personal especializado para su utilización. Más aun, la actual demanda internacional de equipos y suministros médicos ha vuelto evidente la necesidad de contar con una forma de detección específica y confiable producida nacionalmente.
Como opción, ha surgido la microtecnología aplicada a sistemas biológicos. Particularmente, la microfluídica es un área en la cual es posible producir dispositivos integrados capaces de combinar muestras, realizar diluciones, reacciones químicas, procesos de separación, procesos de detección y análisis directos en un mismo dispositivo fabricado en escalas micrométricas, aprovechando los beneficios inherentes de trabajar en estas escalas, como lo son el requerimiento reducido de insumos, la pequeña huella experimental y la habilidad de realizar múltiples pruebas en el mismo dispositivo de forma simultánea1. Más aun, en los últimos años ha tomado popularidad la tecnología de micro gotas. Esta tecnología se enfoca en la generación de gotas miniatura que sirven como pequeños reactores individuales para realizar ensayos bioquímicos, como la amplificación genética, ya sea de ADN o ARN, para facilitar la detección de un microrganismo en una muestra (Fig. 1). Esto significa que, en vez de realizar una prueba por muestra, la muestra puede subdividirse en una enorme cantidad de gotas, donde en cada una se puede realizar una prueba individual. En la UNAM somos pioneros en el desarrollo de esta tecnología, implementándola para realizar la detección de microplasma en cultivos celulares2. En este ejemplo, se parte de una muestra alícuota de 25 µL, la cual, se divide en gotas con un volumen de aproximadamente10 pL, lo que implica la generación de millones de gotas, a tasas de cientos de gotas por segundo. Con tal cantidad de pruebas es posible realizar un análisis estadístico de los resultados generados a partir de experimentos de detección en cada microgota, los cuales, pueden ser por medios ópticos como se muestra en la Figura 1. Este análisis permite aumentar considerablemente la confianza en los resultados de detección obtenidos.
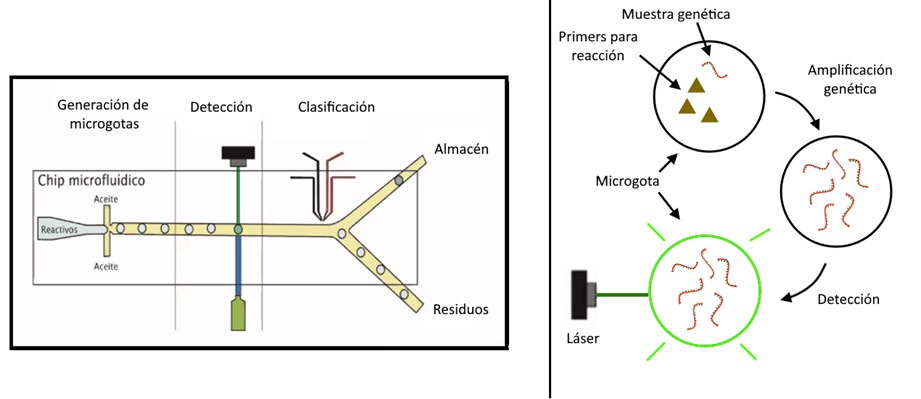
Figura 1. (Izquierda) Plataforma para detección y separación de microgotas por medio de fluorescencia3,4.
(Derecha) Desarrollo de la amplificación genética y subsecuente detección de una muestra de material
genético procesada dentro de una microgota
Es así que un grupo multidisciplinario de investigadoras e investigadores de la UNAM, IPN e IMSS, estamos dados a la tarea de desarrollar y poner en funcionamiento una plataforma que integre etapas de amplificación genética, módulo de detección y procesamiento de datos, necesarias para realizar una prueba para detección viral del virus SARS-CoV-2 en un solo dispositivo basado en microtecnología.
Actualmente, la única prueba conclusiva y avalada por la Organización Mundial de la Salud (OMS) es la técnica RT-PCR (Reverse Transcription Polymerase Chain Reaction) para la detección inequívoca del virus SARS-CoV-2. El diagnóstico molecular usando esta técnica toma como mínimo tres horas en realizarse, incluyendo la preparación de la muestra, la cual, puede afectar notablemente la exactitud del diagnóstico; además, requiere una infraestructura especializada de alto costo como termocicladores y brazos robóticos, además de personal altamente especializado y entrenado para trabajo en áreas de bioseguridad.
Afortunadamente, se han desarrollado otras técnicas para el diagnóstico molecular basadas en amplificación genética isotérmica, las cuales, presentan como beneficios clave su rapidez, sensibilidad y que no requieren de la infraestructura de un laboratorio para llevarlos a cabo5,6. Una de estas técnicas ampliamente utilizada es LAMP (Loop-mediated Isothermal Amplification) que emplea una serie de amplificaciones isotérmicas del ácido nucleico7. Ya hay incluso avances para la implementación de esta técnica en plataformas microfluídicas,
como se muestra en el ejemplo de la Figura 2.
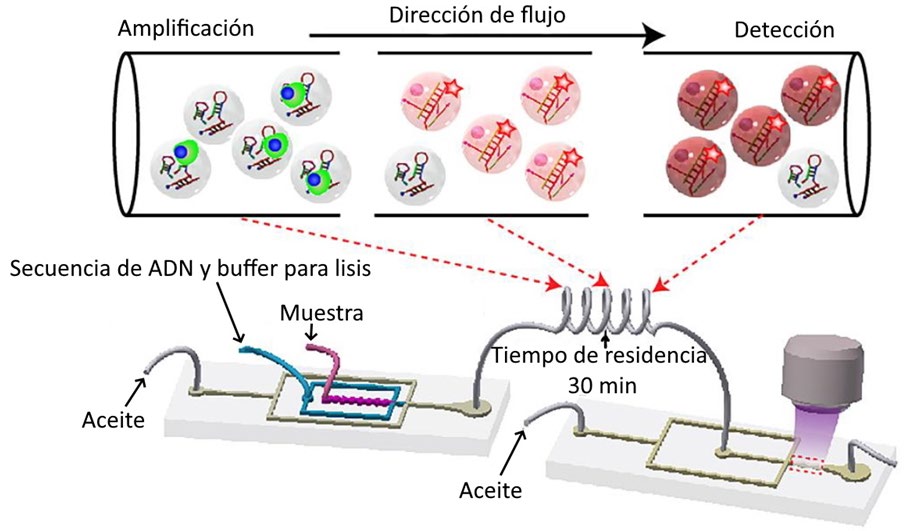
Figura 2. Ejemplo de plataforma microfluídica para detección de miRNA que emplea amplificación genética isotérmica y un método de detección óptico8
Por otra parte, para realizar la detección del virus resulta necesario determinar un esquema de detección que se acoplen a los objetivos de miniaturización y robustez de una plataforma basada en micro tecnología. Se han identificado tres esquemas de detección principales en la literatura: óptica, electroquímica y colorimétrica. Entre ellos, se cuentan las ventajas de ser estrategias altamente sensibles y adecuadas para realizar la detección del virus; sin embargo, existen los retos tecnológicos de miniaturizar su equipamiento asociado, de tal forma que se tenga un instrumento de detección efectivo y portátil que pueda usarse en lugares donde no existe infraestructura hospitalaria, ni laboratorios especializados. Es aquí donde encontramos necesario afrontar estos retos con ingeniería mexicana para lograr el desarrollo de esta plataforma que coadyuve en los esfuerzos por mantener un mejor estado de salud en la sociedad mexicana.
El equipo de trabajo está conformado por:
Dra. Laura Adriana Oropeza Ramos, Facultad de Ingeniería, UNAM.
Dr. Luis Agustín Álvarez Icaza-Longoria, Instituto de Ingeniería, UNAM.
Dra. Eva Ramón Gallegos, Escuela Nacional de Ciencias Biológicas, IPN.
Dr. Luis Fernando Olguín Contreras, Facultad de Química, UNAM.
Dr. Oscar Pilloni Choreño, Instituto de Ingeniería, UNAM.
Dr. Roberto Giovanni Ramírez Chavarría, Instituto de Ingeniería, UNAM.
Dr. Naser Qureshi, Instituto de Ciencias Aplicadas y Tecnología, UNAM.
Dra. Clara Esperanza Santacruz Tinoco, Lab. Central de Epidemiología, Centro Médico Nacional “La Raza", Instituto Mexicano del Seguro Social.
Dr. José Esteban Muñoz Medina, Lab. Central de Epidemiología, Centro Médico Nacional “La Raza", Instituto Mexicano del Seguro Social. Centro de Referencia COVID para el IMSS autorizado por el INDRE.
Referencias
1. A. Kalantarifard; A. Saateh y C. Elbuken (2018). “Label-free sensing in microdroplet-based microfluidic systems”. Chemosensors. vol. 6, no. 2, 2018, doi: 10.3390/chemosensors6020023.
2. B. L. Callejas (2019). “Implementación de la reacción LMAP en dispositivo m microfluídico de gotas como sistema de detección de Mycoplasma ssp. en cultivo celular”. Tesis de Maestría en Ciencias en Biomedicina y Biotecnología Molecular, Instituto Politécnico Nacional”.
3. E. O. Morales (2017). “Diseño y construcción de un separador de micro gotas fluorescentes en chip”. Tesis de Maestría en Ingeniería Eléctrica, Universidad Nacional Autónoma de México.
4. B. Vazquez; N. Qureshi; L. Oropeza-Ramos y L. F. Olguin (2014). “Effect of velocity on microdroplet fluorescente quantified by laser-induced fluorescence”. Lab Chip. vol. 14, no. 18, pp. 3550–3555, doi: 10.1039/ c4lc00654b.
5. A. Niemz; T. M. Ferguson y D. S. Boyle (2011). “Point-of-care nucleic acid testing for infectious diseases”. Trends Biotechnol. vol. 29, no. 5, pp. 240–250, May 2011, doi: 10.1016/j.tibtech.2011.01.007.
6. Z. K. Njiru (2012). “Loop-mediated isothermal amplification technology: Towards point of care diagnostics”. PLoS Negl. Trop. Dis. vol. 6, no. 6, pp. 1-4, 2012, doi: 10.1371/journal.pntd.0001572.
7. I. Abbasi; O. D. Kirstein; A. Hailu y A. Warburg (2016). “Optimization of loop-mediated isothermal amplification (LAMP) assays for the detection of Leishmania DNA in human blood samples”. Acta Trop., vol. 162, pp. 20-26, 2016, doi: 10.1016/j.actatropica.2016.06.009.
8. S. Guo; W. N. Lin; Y. Hu; G. Sun; D. T. Phan y C. H. Chen (2018). “Ultrahigh-throughput droplet microfluidic device for single-cell miRNA detection with isothermal amplification”. Lab Chip. vol. 18, no. 13, pp. 1914-1920, 2018, doi: 10.1039/c8lc00390d.