Como resultado de las emisiones antropogénicas a la atmósfera relacionadas principalmente con la generación de energía (25%) y otras actividades industriales (21%), los gases de efecto invernadero continúan acumulándose en la atmósfera a un ritmo acelerado con impactos negativos sobre el medio ambiente y la salud. Dentro de los gases de efecto invernadero, el CO2 es uno de los más abundantes, con aproximadamente 65% de las emisiones; la concentración de CO2 atmosférico actualmente es de 414 ppm[1]. México ocupa el lugar número 12 a nivel mundial y el primer lugar en América Latina en emisiones de dióxido de carbono. Para contribuir con la reducción de estas emisiones, se han implementado algunas tecnologías para la captura, almacenamiento y utilización de CO2 (CCUS, por sus siglas en inglés). Las CCUS (Figura 1) son una serie de prácticas disponibles para mitigar las emisiones de CO2 proveniente de fuentes fijas, tales como plantas de producción de energía, fabricación de acero y cemento. La etapa de captura o separación del CO2 se puede llevar a cabo mediante absorción con aminas, destilación criogénica, separación con membranas y adsorción con sólidos. La adsorción con sólidos es una alternativa prometedora para la captura de CO2, ya que los materiales adsorbentes pueden reutilizarse, son de fácil manipulación, existe una amplia variedad de adsorbentes disponibles para diferentes temperaturas de operación y presentan altas capacidades de captura de CO2.
![Figura 1. Captura, almacenamiento y utilización/conversión del CO2. Adaptado de [2]](/es-mx/AlmacenDigital/Gaceta/GacetaNoviembre-Diciembre2021/PublishingImages/04-materiales-adsorbentes-co2_01.jpg)
Figura 1. Captura, almacenamiento y utilización/conversión del CO2. Adaptado de [2]
Dentro de los materiales adsorbentes, el óxido de calcio y los cerámicos alcalinos son los que presentan mejores propiedades de captura de CO2 a elevadas temperaturas. Los cerámicos alcalinos se definen como un óxido de metal binario, donde al menos uno de los metales es un elemento alcalino como Li, K y Na; entre los que destacan zirconatos, silicatos, cupratos, titanatos, cobaltatos, aluminatos y ferritas de litio y sodio; para los que el grado de adsorción de CO2 está influenciado por factores como la temperatura, presión, concentración de CO2 en la corriente gaseosa, tamaño de partícula, estructura cristalina y transiciones de fase estructurales durante la síntesis del cerámico. Estos materiales poseen una alta selectividad al CO2 a elevadas temperaturas, cinética adecuada de adsorción-desorción, buenas propiedades de regeneración y alta estabilidad térmica y mecánica. Por lo que buscar alternativas de bajo costo para su síntesis, sin comprometer su eficiencia y estabilidad, es el objetivo del presente trabajo.
Bajo este escenario, utilizar residuos y/o sub-productos industriales para la síntesis de estos materiales ofrece ventajas como abundancia, disponibilidad y bajo costo. En el grupo de trabajo se han utilizado como materia prima escorias metalúrgicas de hierro, acero, cobre y sílice, obtenidas de la planta geotérmica de Cerro Prieto en Baja California, por su alto contenido en calcio, hierro y sílice.
Ortosilicato de litio, Li4SiO4
El Li4SiO4 fue preparado utilizando escorias de hierro como fuente de SiO2 por el método de reacción en estado sólido. En la figura 2 se puede observar que el material alcanza una capacidad de adsorción de CO2 mayor al Li4SiO4 sintetizado a partir de sílice comercial con PCO2=0.05 y 0.20 en la corriente gaseosa. El silicato derivado de escoria presenta una captura máxima de 135 mgCO2/g a 675ºC con PCO2=0.05. Además, los silicatos de litio preparados con escoria presentan alta estabilidad durante 20 ciclos consecutivos de adsorción-desorción [3].
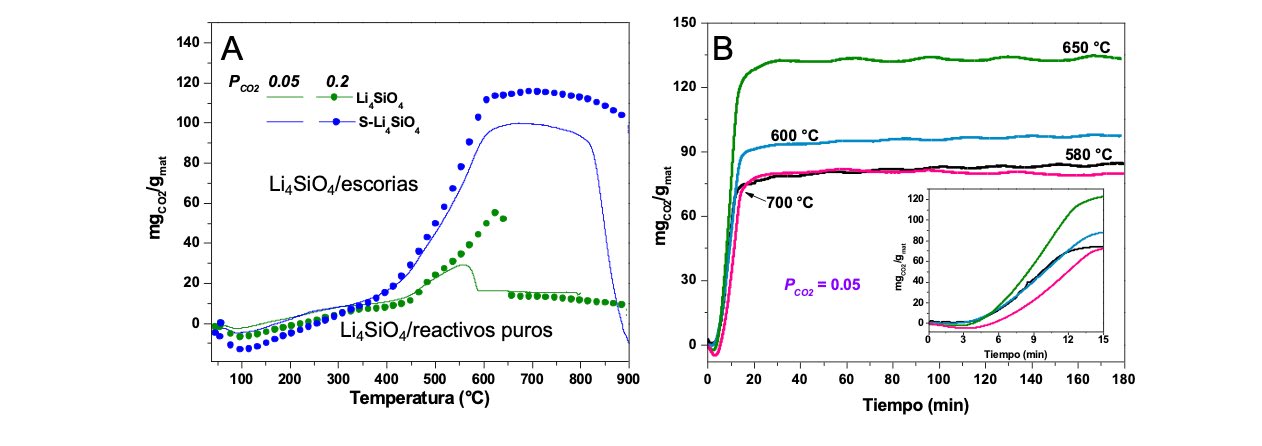
Figura 2. Adsorción de CO2 del Li4SiO4: A) Termogramas dinámicos con PCO2=0.05 y 0.20 y B) Isotermas a 650ºC y PCO2=0.05
Ferrita de pentalitio, Li5FeO4
La Li5FeO4 fue elaborada utilizando escorias metalúrgicas de cobre como fuente de Fe2O3 utilizando el método de reacción en estado sólido. Los resultados del análisis termogravimétrico mostraron que la adsorción de CO2 en el material ocurre en tres etapas (Figura 3). La primera etapa se asocia a la formación del Li2CO3 en la superficie del material. Posteriormente, en la segunda etapa del proceso, la adsorción de CO2 aumenta con mayor velocidad, este comportamiento se asocia a que el incremento de temperatura activa el proceso de difusión de CO2 y de iones Li+ y O2- en el material, por tanto, la quimisorción comienza a llevarse a cabo en el volumen de la Li5FeO4 y no sólo en su superficie. En la tercera etapa, después de que se alcanza la temperatura máxima de carbonatación del material, comienza el proceso de desorción o descarbonatación, descrita por la pérdida de masa en el material. De los experimentos dinámicos, se determinó que el intervalo de mayor adsorción de CO2 es de 400 a 700°C. Posteriormente, en los experimentos isotérmicos (Figura 4), la isoterma a 675°C mostró la mayor captura de CO2, 200 mgCO2/g. A partir de estos resultados, se realizaron experimentos isotérmicos a distintas PCO2 (0.05, 0.10, 0.15 y 0.20) a 675°C, donde la mayor captura de CO2 se obtuvo con PCO2=0.20, este comportamiento confirma que la capacidad máxima de captura disminuye cuando la PCO2 disminuye hasta 11.6% con PCO2=0.05.
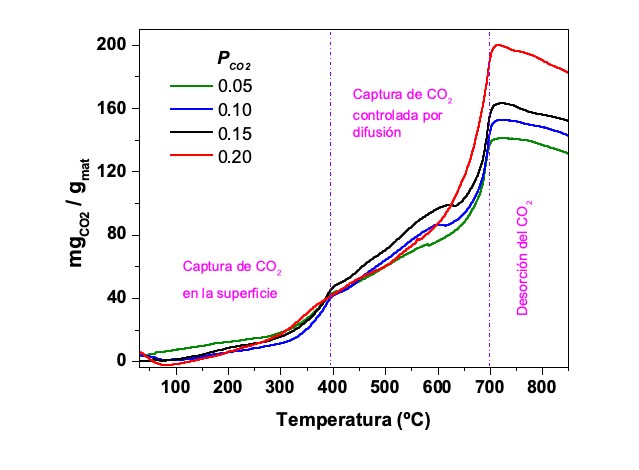
Figura 3. Termogramas dinámicos de Li5FeO4 sintetizado a partir de escorias metalúrgicas de cobre en flujo de CO2 (PCO2= 0.05 - 0.20)
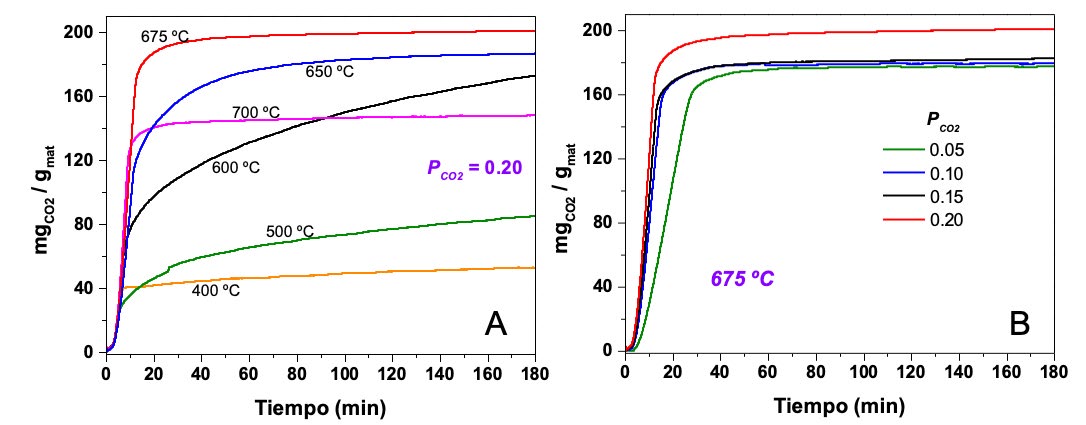
Figura 4. Análisis isotérmico de Li5FeO4 sintetizado a partir de escorias metalúrgicas de cobre A) a diferentes temperaturas con PCO2=0.2 y B) a 675 °C con PCO2= 0.05, 0.10, 0.15 y 0.20
Comentarios finales
Los adsorbentes derivados de residuos y sub-productos industriales poseen muchas ventajas que incluyen disponibilidad, regeneración, bajo costo y menor corrosión. Sin embargo, su aplicación aún enfrenta varios retos que superar antes de que pueda adoptarse para aplicaciones a gran escala:
• Demostrar detalladamente la estabilidad de los materiales para determinar su practicidad y rentabilidad efectiva.
• Evaluar la adsorción de CO2 en presencia de otros gases, NOx y SOx.
• Los residuos tienen impurezas, por lo que es fundamental identificar todos los subproductos formados durante la síntesis y la adsorción de CO2.
• Proponer alternativas para su disposición.
Agradecimientos
Este trabajo fue financiado por el proyecto PAPIIT IA100520.
Contacto:
Dra. Brenda Cecilia Alcántar Vázquez
Referencias
National Oceanic and Atmospheric Administration Global Monitoring Laboratory - Carbon Cycle Greenhouse Gases. Recuperado de https://www.esrl. noaa.gov/gmd/ccgg/trends/mlo.html.
Pen-Chi, C. y Shu-Yuan, P. (2017). Carbon dioxide mineralization and utilization. Springer.
Alcántar-Vázquez, B. C. y Ramírez-Zamora, R. M. (2020). Lithium silicates synthesized from iron and steel slags as high temperature CO2 adsorbent